Untitled
Servicio de Psiquiatría-CAS Vall d’HebronAgencia de Salud Pública de Barcelona (ASPB)Programa Clínico DepresiónServicio de Psiquiatría3Servicio de Psiquiatría del Parc Sanitari Sant Joan de DéuInstituto Clínico de NeurocienciasHospital Clínic de BarcelonaHospital Universitari de Bellvitge-IDIBELLCIBERSAM INTRODUCTION bupropion in the treatment of addiction in patients with coca
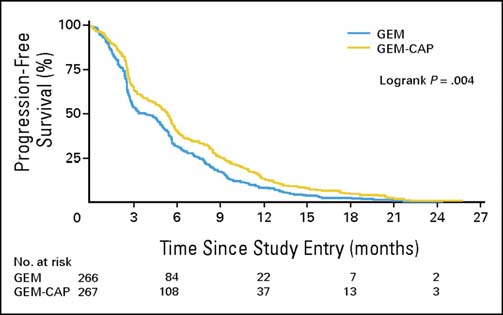
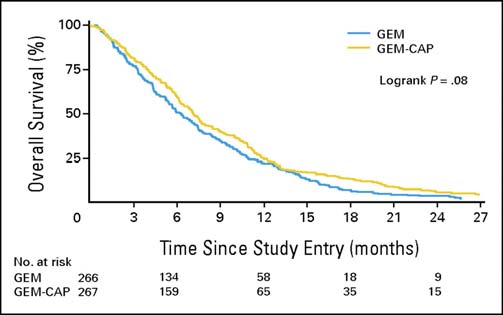 Cunningham et coll
Cunningham et coll